Life Full Of Water
這是一個有關介紹水的網站
2012年6月19日 星期二
水~水溶液介紹
水可以用來溶解很多種物質,是很好的無機溶劑,用水作溶劑的溶液,即稱為水溶液。用"aq"作為記號,如「HCl(aq)」。
當物質溶解於水時,離子化合物在水中發生電離,以離子態存在,這樣的溶液一般是透明的。當分子溶於水時,有些可以與水發生反應,形成新物質,這些新物質溶解於水中,或者這些分子直接填補水分子間的空隙。這些分子、離子等都是溶質。特別需要注意的是,如果不作特殊說明,「xx溶液」,指的就是"xx"的水溶液。任何含有水的溶液,都必須稱為「xx的水溶液」,即不管溶質於水的比例,只要有水存在,都應該把水當作溶劑。
對於大部分物質,它們能在水中溶解的質量是有限度的。這種限度叫做溶解度。有些物質可以和水以任意比例互溶,如「乙醇」,但絕大多數物質在達到溶解度時,就不再溶解。會形成沉澱或者放出氣體,這種現象叫做析出。
還有一種特殊的狀態,叫做膠體。膠體中,粒子的大小在100nm左右,由於電荷的作用不沉澱,懸浮在溶液中。牛奶是一種常見的膠體。
由於被溶解物質(稱作溶質)的顆粒大小和溶解度不同,水溶液的透明度會有所不同,較透明的稱作真溶液,較混濁的稱作膠態溶液(又稱假溶液),有些膠態溶液還會進一步在底部形成沉澱,成為沉澱膠態溶液。
資料來源:維基百科http://zh.wikipedia.org/wiki/%E6%B0%B4#.E5.8F.A4.E4.BB.A3.E4.B8.96.E7.95.8C.E8.A7.82.E4.B8.AD.E7.9A.84.E6.B0.B4
2012年6月11日 星期一
水~基本性質
水
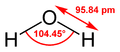

IUPAC命名:氧烷〔Oxidane〕、水〔Water〕
別名:一氧化二氫〔Dihydrogen Monoxide〕
氫氧化氫〔Hydrogen Hydroxide〕
氫氧酸〔Hydroxic acid〕
氧化氫(Hydrogen Oxide)
羥酸(Hydroxylic acid、Hydroxilic acid)
二氫氧化物
μ-氧合二氫
化學式:H2O
摩爾質量:18.01524 g·mol−1
外觀:白色固體或近無色微藍透明晶體或液體
密度:1000 kg·m−3 (液,4 °C) 917 kg·m−3 (固)
熔點:0 °C, 32 °F (273.15 K)
沸點:100 °C, 212 °F (373.15 K)
黏度:0.001 Pa·s, 20 °C
晶體結構:六方
分子構型:角形
資料來源:維基百科http://zh.wikipedia.org/wiki/%E6%B0%B4%E5%88%86%E5%AD%90#.E7.83.AD.E5.86.B0


IUPAC命名:氧烷〔Oxidane〕、水〔Water〕
別名:一氧化二氫〔Dihydrogen Monoxide〕
氫氧化氫〔Hydrogen Hydroxide〕
氫氧酸〔Hydroxic acid〕
氧化氫(Hydrogen Oxide)
羥酸(Hydroxylic acid、Hydroxilic acid)
二氫氧化物
μ-氧合二氫
化學式:H2O
摩爾質量:18.01524 g·mol−1
外觀:白色固體或近無色微藍透明晶體或液體
密度:1000 kg·m−3 (液,4 °C) 917 kg·m−3 (固)
熔點:0 °C, 32 °F (273.15 K)
沸點:100 °C, 212 °F (373.15 K)
黏度:0.001 Pa·s, 20 °C
晶體結構:六方
分子構型:角形
資料來源:維基百科http://zh.wikipedia.org/wiki/%E6%B0%B4%E5%88%86%E5%AD%90#.E7.83.AD.E5.86.B0
水~性質~表面張力
由於水具有所有非金屬液體中最大的表面張力值72.8 mN/m,使水滴保持相對穩定。當少量水滴滴在玻璃板上,即可觀察到水的表面張力:水滴繼續保持液滴狀態。另一個常見的例子是,向一杯注滿水的玻璃杯中緩緩投放硬幣,水不會立刻溢出,而是向上凸起。水的這一特性對生物來說非常重要。例如,植物吸水時,水通過莖里的木質部向上運輸。強大的分子間作用力維持維管束中水的柱狀形態,粘接性使水柱聚集,粘性是水緊貼維管束壁,而張力則防止因蒸騰作用而導致水柱斷裂。其他低張力的液體則會導致水柱裂開,形成真空,使蒸騰作用失效。
資料來源:維基百科http://zh.wikipedia.org/wiki/%E6%B0%B4%E5%88%86%E5%AD%90#.E7.83.AD.E5.86.B0
資料來源:維基百科http://zh.wikipedia.org/wiki/%E6%B0%B4%E5%88%86%E5%AD%90#.E7.83.AD.E5.86.B0
水~性質~密度
大部分物質固態時的密度比液態時要高;因此,一塊固態純「物質」會沉入液態的純「物質」中。但是,一塊普通的冰卻會在水上浮,這是因為固態水的密度比液態水要「低」。這是水的一項非常重要的特性。在室溫時,液態水在溫度降低時密度會增加,這跟一般物質無異。但在接近冰點的4°C 時,水達到其最大密度,而且當水的溫度繼續向冰點下降,在標準狀態下液態水會膨脹,密度並因此會變「低」。這現象的物理原因跟普通冰的晶體結構有關,該結構又被稱為六角形冰Ih。水、鎵、鉍、銻和矽都會在凝固時膨脹;其他大部份材料則收縮。但要注意的是,並不是所有種類的冰密度都比液態水低。例如高密度非結晶冰和超高密度非結晶冰的密度都比液態純水要高。因此,普通冰密度比水高的理由並不能容易地憑直覺所得,而且它跟氫鍵固有的不尋常特性有很大關係。
總的來說,水在凝固時的膨脹是由於其以氫鍵不尋常的彈性而排成的縱列分子結構,以及能量特別低的六角形晶體形態(也就是標準狀態下所採用的形態)。那就是當水冷卻的時候,它嘗試在晶格形態下成堆,而該晶格會把鍵的旋轉及振動分量拉長,所以一個水分子會被鄰近的幾個分子推擠,這實際上就減少了當水在標準狀態下成冰時的水密度ρ。
這特性在地球生態系統中的重要性是不言而喻的。 Ex:「如果」水凝固的時候密度較高的話,極地環境中的湖泊和海洋最後都會結成冰(從上至下)。這是因為此時冰會沉到湖底及河床,而必要的升溫現象在夏季時則因暖水層質量比底下的固態冰層低而發生不了。自然界的一個重要特徵就是上述並不會在環境中自然發生。
然而,冷水(在相關生物系統中的一般自然設定下)因氫鍵而在從冰點以上的4°C所開始產生的不尋常膨脹,為淡水生物在冬季提供了一重要的好處。在表面上被冷凍的水沉下,形成提供對流的水流並冷卻整個水體,但當湖水到達4°C 時,若繼續冷卻則表面水密度降低,形成一表面層,該層水最後會凝固成冰。由於向下的冷水流被密度的轉變擋住,冬季任何由淡水所成的大水體最冷的水都會在表面附近,離開湖底及河床。這說明了多種不為人知的冰性質,它們跟湖中的冰相關及像二十世紀早期科學家卡夫特(Horatio D. Craft)所描述的「跌出湖的冰」。
資料來源:維基百科http://zh.wikipedia.org/wiki/%E6%B0%B4%E5%88%86%E5%AD%90#.E7.83.AD.E5.86.B0
總的來說,水在凝固時的膨脹是由於其以氫鍵不尋常的彈性而排成的縱列分子結構,以及能量特別低的六角形晶體形態(也就是標準狀態下所採用的形態)。那就是當水冷卻的時候,它嘗試在晶格形態下成堆,而該晶格會把鍵的旋轉及振動分量拉長,所以一個水分子會被鄰近的幾個分子推擠,這實際上就減少了當水在標準狀態下成冰時的水密度ρ。
這特性在地球生態系統中的重要性是不言而喻的。 Ex:「如果」水凝固的時候密度較高的話,極地環境中的湖泊和海洋最後都會結成冰(從上至下)。這是因為此時冰會沉到湖底及河床,而必要的升溫現象在夏季時則因暖水層質量比底下的固態冰層低而發生不了。自然界的一個重要特徵就是上述並不會在環境中自然發生。
然而,冷水(在相關生物系統中的一般自然設定下)因氫鍵而在從冰點以上的4°C所開始產生的不尋常膨脹,為淡水生物在冬季提供了一重要的好處。在表面上被冷凍的水沉下,形成提供對流的水流並冷卻整個水體,但當湖水到達4°C 時,若繼續冷卻則表面水密度降低,形成一表面層,該層水最後會凝固成冰。由於向下的冷水流被密度的轉變擋住,冬季任何由淡水所成的大水體最冷的水都會在表面附近,離開湖底及河床。這說明了多種不為人知的冰性質,它們跟湖中的冰相關及像二十世紀早期科學家卡夫特(Horatio D. Craft)所描述的「跌出湖的冰」。
資料來源:維基百科http://zh.wikipedia.org/wiki/%E6%B0%B4%E5%88%86%E5%AD%90#.E7.83.AD.E5.86.B0
2012年6月5日 星期二
水~南灣之水(畢旅2nd Day)
剛好最近畢旅結束,就順道來發一篇我們造訪南灣的文章吧!!
墾丁南灣的水相當的清澈,一抹深藍色顏料摻雜著一弧一弧的白色鑲邊與淺藍色的天空相互輝映著,如同大多數的沙灘邊海景,但不一樣的是在一旁興致勃勃的一群瘋狂高中生。
來到沙灘免不了要玩一玩水,但每個人對待這片美麗海洋的玩樂方式卻大不相同,有人閒情雅致的佇在一旁享受海浪沖刷四肢、有人站在離岸五十米觀賞著海洋的壯麗、有人大膽又熱情的直接和海洋來一場愛的擁吻,我應該就是屬於第三種吧!
但是第三種互動方式卻含有兩種內涵,一是自發性地坐在或甚至躺在岸邊體驗海浪沖刷,另一則是─非常悽慘的─被一群"友好"同學直接帶著你去和海洋擁吻一番,那第二種感覺真是種特別的經歷,尤其是擁吻後那不時刺激著你舌頭的鹹味和苦味,更是令人印象深刻呢!
水的一種形態─海洋,裡面富含著氯化鈉、氯化鎂,此二者令你又苦又鹹,但引用《第九味》中所描述的味道,海洋不僅是"味之俗者(鹹)"也是"味之隱逸者(苦)",或許海洋正是那種當你親近他、接觸他或是使用他時,他可以很一般性的讓你利用、讓你了解,但當他變成另一種隱者的形態時,即使你再靠近也無法體會其中奧妙和深度,正如同當你位在台灣最南端(不是鵝鑾鼻喔!)欣賞著廣闊無邊的巴士海峽海水,他的遙遠、水深、底下的起伏動盪是我們無法輕易理解的!海洋應該就是這麼樣神秘又親合的角色吧!相信當我們細心體會海洋,我們還可以從他的身上得到意想不到的體悟的!
P.S 這一趟畢旅南灣之遊,我原本不打算下水的,但我還是被9816的壞小孩:吳奉儒、廖彥婷 給推下水了0.0,不過玩完水後還是挺開心的,這裡也向那些被我拖下水的人說聲SORRY囉!
墾丁南灣的水相當的清澈,一抹深藍色顏料摻雜著一弧一弧的白色鑲邊與淺藍色的天空相互輝映著,如同大多數的沙灘邊海景,但不一樣的是在一旁興致勃勃的一群瘋狂高中生。
來到沙灘免不了要玩一玩水,但每個人對待這片美麗海洋的玩樂方式卻大不相同,有人閒情雅致的佇在一旁享受海浪沖刷四肢、有人站在離岸五十米觀賞著海洋的壯麗、有人大膽又熱情的直接和海洋來一場愛的擁吻,我應該就是屬於第三種吧!
但是第三種互動方式卻含有兩種內涵,一是自發性地坐在或甚至躺在岸邊體驗海浪沖刷,另一則是─非常悽慘的─被一群"友好"同學直接帶著你去和海洋擁吻一番,那第二種感覺真是種特別的經歷,尤其是擁吻後那不時刺激著你舌頭的鹹味和苦味,更是令人印象深刻呢!
水的一種形態─海洋,裡面富含著氯化鈉、氯化鎂,此二者令你又苦又鹹,但引用《第九味》中所描述的味道,海洋不僅是"味之俗者(鹹)"也是"味之隱逸者(苦)",或許海洋正是那種當你親近他、接觸他或是使用他時,他可以很一般性的讓你利用、讓你了解,但當他變成另一種隱者的形態時,即使你再靠近也無法體會其中奧妙和深度,正如同當你位在台灣最南端(不是鵝鑾鼻喔!)欣賞著廣闊無邊的巴士海峽海水,他的遙遠、水深、底下的起伏動盪是我們無法輕易理解的!海洋應該就是這麼樣神秘又親合的角色吧!相信當我們細心體會海洋,我們還可以從他的身上得到意想不到的體悟的!
P.S 這一趟畢旅南灣之遊,我原本不打算下水的,但我還是被9816的壞小孩:吳奉儒、廖彥婷 給推下水了0.0,不過玩完水後還是挺開心的,這裡也向那些被我拖下水的人說聲SORRY囉!
2012年5月26日 星期六
水~自我介紹
水(Water)是個神奇的東西,他充斥在你我的生活當中。
從最基本的人類的組成談起,大家都知道我們身體是由約70%的水組成,水幫助我們身體進行消化作用;血漿中90%也是水,幫助我們運輸所需的養分、激素和該排泄的廢物;他也能幫助我們衡定體溫。
從生活中的角色來看,他是我們每天生存所必需的東西,人一天一定得喝一定量的水;每次的灌溉也一定要有水,畢竟作物也得"喝水";工業用水更不用說了;發電廠也很需要水,不論火力、水力、核能都需要。
水的魔力非常強大,不論哪一個領域都跟水有相當大的關係和關聯,我將會在接下來的內容中針對"水"的每項特質一一介紹,也會有關於水的體悟喔!!
盡請期待XD~~
從最基本的人類的組成談起,大家都知道我們身體是由約70%的水組成,水幫助我們身體進行消化作用;血漿中90%也是水,幫助我們運輸所需的養分、激素和該排泄的廢物;他也能幫助我們衡定體溫。
從生活中的角色來看,他是我們每天生存所必需的東西,人一天一定得喝一定量的水;每次的灌溉也一定要有水,畢竟作物也得"喝水";工業用水更不用說了;發電廠也很需要水,不論火力、水力、核能都需要。
水的魔力非常強大,不論哪一個領域都跟水有相當大的關係和關聯,我將會在接下來的內容中針對"水"的每項特質一一介紹,也會有關於水的體悟喔!!
盡請期待XD~~
2012年4月17日 星期二
訂閱:
文章 (Atom)